La hibridación consiste en una mezcla de orbitales puros en un estado excitado para formar orbitales híbridos equivalentes con orientaciones determinadas en el espacio.
ORBITALES: Un orbital es una región del espacio en donde la probabilidad de encontrar a un electrón es alta. Las formas de los orbitales s , p , d se muestran en las figuras siguientes.
Hibridación sp3 o tetraédrica
Para los compuestos en los cuales el carbono presenta enlaces simples, hidrocarburos saturados o alcanos, se ha podido comprobar que los cuatro enlaces son iguales y que están dispuestos de forma que el núcleo del átomo de carbono ocupa el centro de un tetraedro regular y los enlaces forman ángulos iguales de 109º 28' dirigidos hacia los vértices de un tetraedro. Esta configuración se explica si se considera que los tres orbitales 2p y el orbital 2s se hibridan para formar cuatro orbitales híbridos sp3.
Metano



Hibridación sp2
En la hibridación trigonal se hibridan los orbitales 2s, 2px y 2 py, resultando tres orbitales idénticos sp2 y un electrón en un orbital puro 2pz .
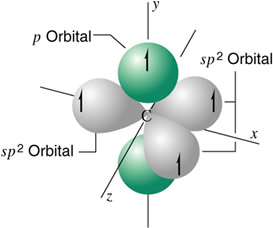
Un átomo de carbono hibridizado sp2
El carbono hibridado sp2 da lugar a la serie de los alquenos.
La molécula de eteno o etileno presenta un doble enlace:
- un enlace de tipo σ por solapamiento de los orbitales hibridos sp2
- un enlace de tipo π por solapamiento del orbital 2 pz
El enlace π es más débil que el enlace σ lo cual explica la mayor reactividad de los alquenos, debido al grado de insaturación que presentan los dobles enlaces.
Etileno
El etileno, C2H4, es el alqueno más sencillo. Posee dos átomos de hidrógeno menos que el etano, por lo que cada carbono sólo está unido al otro carbono y a dos átomos de hidrógeno. Su estructura se explica admitiendo la hibridación sp2 para sus átomos de carbono. Cada carbono utiliza uno de los orbitales híbridos que posee para formar un enlace s con el otro y los dos restantes para solaparse con los orbitales s de dos átomos de hidrógeno, formándose así cuatro orbitales moleculares s carbono-hidrógeno. La molécula de etileno consta, por tanto, de cinco enlaces fuertes de tipo s, uno carbono-carbono y cuatro carbono-hidrógeno:

Hibridación sp
Los átomos que se hibridan ponen en juego un orbital s y uno p, para dar dos orbitales híbridos sp, colineales formando un ángulo de 180º. Los otros dos orbitales p no experimentan ningún tipo de perturbación en su configuración.
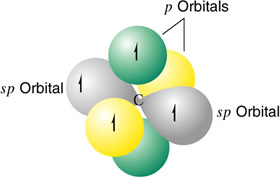
Un átomo de carbono hibridizado sp
El ejemplo más sencillo de hibridación sp lo presenta el etino. La molécula de acetileno presenta un triple enlace:
a. un enlace de tipo σ por solapamiento de los orbitales hibridos sp
b. dos enlaces de tipo π por solapamiento de los orbitales 2 p.
b. dos enlaces de tipo π por solapamiento de los orbitales 2 p.
Acetileno
El acetileno, C2H2, es el alquino más sencillo. Posee dos átomos de carbono con hibridación sp enlazados entre sí y cada uno a un átomo de hidrógeno. Estas uniones, según la teoría del enlace de valencia, se producen a través de los solapamientos de los dos orbitales híbridos de cada carbono entre sí y con los orbitales s de dos átomos de hidrógeno que originan tres enlaces fuertes s, uno carbono-carbono y dos carbono-hidrógeno, quedando los cuatro átomos alineados en línea recta. Pero además, cada átomo de carbono posee otros dos orbitales p sin hibridar cuyos ejes son perpendiculares entre sí y con el eje de los dos orbitales híbridos, y como en el caso del etileno, pueden solaparse lateralmente para originar dos orbitales moleculares p, cuyos cuatro lóbulos (dos de cada orbital) envuelven prácticamente a los dos átomos de carbono, que quedan así enlazados por un triple enlace formado por un enlace fuerte s y dos más débiles p.



